冷冻电镜结合Nanodisc在膜蛋白研究的应用
细胞生物膜所含的蛋白称为膜蛋白,其参与和行使了众多细胞功能,包括细胞与外界进行物质运输、信息传递、能量交换等。膜蛋白担任了各种神经信号分子、激素和其他底物的受体,构成了各种离子跨膜的通道,以及构成各类转运蛋白。在人体蛋白中,有大约 30% 是膜蛋白。FDA 批准的新药中,大多数都以膜蛋白为靶点。
第一:组装溶解在去污剂中的膜蛋白在去污剂存在条件下将膜蛋白纯化,然后再添加MSPs和磷脂。含有膜蛋白的Nanodiscs能够自发地组装,在去除掉表面活性剂后可以通过凝胶过滤(排阻层析)等方式来纯化。
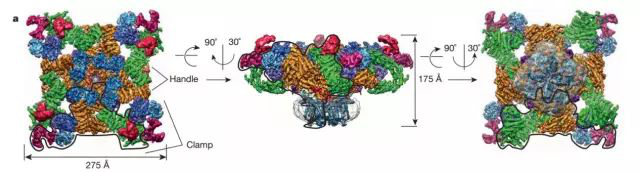
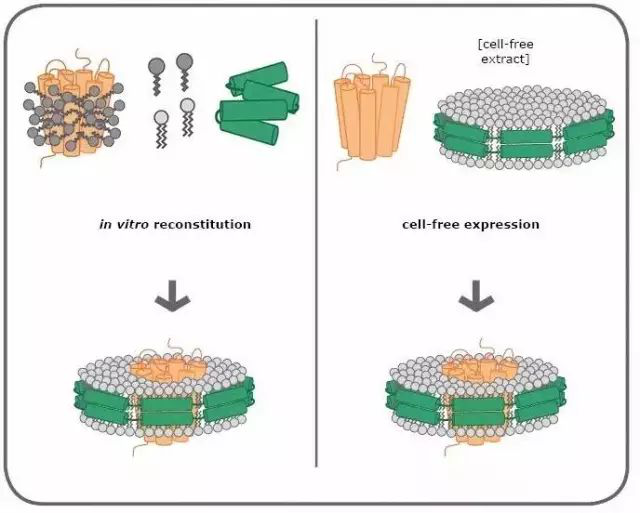 图3:膜蛋白与Nanodisc的两种组装机制(图片来源Cube Biotech官方网站)
图3:膜蛋白与Nanodisc的两种组装机制(图片来源Cube Biotech官方网站)
参考文献:
1. Yifan Cheng , et al. A Primerto Single-ParticleCryo-Electron Microscopy. 161(3):438 (2015).
2. Elad Binshtein, Melanie D. OhiCryo-Electron Microscopy and theAmazing Race to Atomic Resolution [J].Biochemistry, 54: 3133-3141 (2015).
3. Yifan Cheng , et al. Single-particleelectron cryomicroscopy. Nature Methods 11, 30 (2014).
4. Li, X. et al. Electron countingand beam-induced motion correction enablenear-atomic-resolution single-particlecryo-EM. Nature Methods 10, 584–590(2013)
5. Bayburt, T.H., Grinkova, Y.V.& Sligar, S.G. Self-assembly of discoidal phospholipid bilayer nanoparticleswith membrane scaffold proteins. Nano Lett. 2, 853–856 (2002).
6. Bartesaghi A, Merk A, BanerjeeS, Matthies D, Wu X, Milne JL, Subramaniam S. Electron microscopy. 2.2 Åresolution cryo-EM structure of β-galactosidase in complex with a cell-permeantinhibitor. Science. 5;348(6239):1147-51 (2015).
7. Sun L, Zhang X, Gao S, Rao PA,Padilla-Sanchez V, Chen Z, Sun S, Xiang Y, Subramaniam S, Rao VB, Rossmann MG.Cryo-EM structure of the bacteriophage T4 portal protein assembly atnear-atomic resolution. Nat Commun. 6;6:7548 (2015).
8. Ilia G Denisov,Sligar, S.G. Nanodiscsfor structural and functional studies of membrane proteins. Nature Structural &Molecular Biology23,481–486(2016)
9. Rouslan G. E, et al. Architecture and conformationalswitchmechanism of the ryanodine receptor. Nature 517. 39 (2015).
10. Lagers tröm, M.C. et al.Structural diversity of Gprotein-coupled receptors and significance for drugdiscovery. Nature Reviews Drug Discovery 7, 339-357 (2008).
11. Hagn, F. et al. Optimizedphospholipid bilayer Nanodiscs facilitate high-resolution structuredetermination of membrane proteins. J.Am.Chem. Soc., 135:1919-1925(2013).
12. Wang, Z. et al. Tyrosinephosphorylation of Mig6 reduces its inhibition of the epidermal growth factorreceptor. ACS Chem. Biol. 8(11):2372-6, (2013).
13. Timothy H. B, et al. TransducinActivation by Nanoscale Lipid Bilayers ContainingOne and Two Rhodopsins. JOURNALOF BIOLOGICAL CHEMISTRY. 282 (2007).
14. Krueger-K, et al. An evaluationof detergents for NMR structural studies of membrane Proteion. J Biomol NMR,28(1) 43-57 (2004).
15. Yoshiura C, et al. NMR analysesof the interaction between CCR5 and its ligand using functionalreconstitutionof CCR5 in lipid bilayers. J Am Chem Soc, 132 (19): 6 768-6 777 (2010).
16. Erik Henrich, et al. Analyzingnative membrane proteinassembly in nanodiscs by combined noncovalent massspectrometry and syntheticbiology. eLife6:e20954 (2017).
17. Moers et al., Modified lipidand protein dynamics in Nanodiscs. Biochim. Biophys. Acta, 1828(4):1222-9, (2013).
18. Nasr. et al., Radioligandbinding to Nanodisc-reconstituted membrane transporters assessed by thescintillation proximity assay. Biochemistry, 14;53(1):4-6, (2014).
19. 毕允晨,王玉娟,王俊峰.Nanodisc体系在膜蛋白结构与功能研究中的应用。 《波谱学杂志》, 28(2):177-189(2011)
20. 张凯.什么是2015年最受科学界关注的新技术?知乎专栏,(2016)
21. 程亦凡博士Nature发表突破性成果.生物通.(2016)
22. Nature Methods公布2015年度技术-生物通,(2016)










 首页
首页 Facebook
Facebook WeChat
WeChat Twiitter
Twiitter
