NTA vs. IDA:NTA和IDA的区别和选择– Cube Biotech
如果您正在使用固定化金属亲和层析(IMAC)纯化蛋白,您使用的金属离子很可能是通过次氮基三乙酸(NTA)或者亚氨基二乙酸(IDA)偶联到树脂基质上的。在众多可用于IMAC的螯合配体中,NTA和IDA是常用的两种。您更倾向于使用哪种螯合配体?您为何选择该配体?这两种配体有什么不同?为了帮助我们的客户在充分了解产品的情况下做出订购决定,我们以PureCube Ni-NTA 琼脂糖和PureCube Ni-IDA 琼脂糖为例,详细介绍二者的异同。
两种配体在结构上和化学上有何不同?
螯合配体如何影响蛋白结合载量?
金属离子在琼脂糖的亲和能力和特异性中扮演什么角色?
NTA和IDA对氧化剂的反应如何?
样品缓冲液中的螯合剂对NTA和IDA的影响有无不同?
NTA vs IDA: 两个配体的说明
固定化金属亲和层析(IMAC)是一种常用的蛋白纯化方法,尤其是纯化带多聚组氨酸标签的重组蛋白。过渡金属离子通过螯合配体被固定在基质上,金属离子能与多聚组氨酸标签相互作用,有效地将带标签的重组蛋白从样品中纯化出来。目前商品化的琼脂糖中常用的两种配体便是NTA和IDA。在这份使用说明中,我们从已发表文章和实验中总结了两种配体的区别以及优缺点,以便为您提供一些思路,使您选择的琼脂糖能得到优秀的纯化结果。
利用金属捕获蛋白质
固定化金属亲和层析(IMAC)解决通常的一步蛋白纯化
从1975年IMAC问世以来,IMAC以及它的变型和改良技术被广泛地应用于蛋白纯化领域。通常情况下,过渡金属离子通过配体固定在基质上,与融合在肽段C-或N-末端的多聚组氨酸标签(由3-10个组氨酸组成)上的咪唑基相互作用。这种相互作用可以有效地将蛋白质从溶液中分离出来,然后通过一定浓度梯度的咪唑洗脱液、改变pH或金属螯合将结合的蛋白从金属离子上洗脱下来。
IMAC的初始用于纯化自身具有金属离子亲和性的天然蛋白质,现在已扩展到纯化磷酸化蛋白,抗体以及一系列带有多聚组氨酸标签的蛋白质。多聚组氨酸标签的突出优点在于它的体积较小,同时免疫原性很低,几乎不会干扰到蛋白质的正常功能。三价或四价离子通常用于磷酸化蛋白的纯化,而二价离子如Ni2+, Cu2+ 和 Zn2+一般用于纯化带组氨酸标签的重组蛋白。
IMAC之所以能得到广泛应用,不仅因为它价格低廉,操作简单,还因为它非常稳定,在很多特殊的蛋白纯化情况中也可以使用。例如,我们需要在非变性或变性条件下纯化蛋白,或者在氧化及还原环境中纯化蛋白,都可以使用IMAC。另外,IMAC可耐受多种化学物质。总而言之,IMAC还具有高亲和性,高特异性和易放大性,这使得蛋白纯化甚至是从粗裂解液中纯化都变得非常有效。
不仅仅是蛋白纯化
IMAC作为一种通用技术,其应用之广,非常惊人。表面固定化组氨酸标记抗原可增加以ELISA为基础的诊断工具的灵敏度。IMAC也可以介导功能域表面蛋白与蛋白相互作用的研究。在蛋白组学研究中,IMAC可用于预分离阶段来减少对象样品的复杂性。最后,利用螯合原理,样品与耦联螯合配体的基质一同孵育,配体可减少PCR的金属离子抑制剂,因此能快速产生用于扩增的样品。
选择螯合配体:选择哪一种?
配体的配位数对洗脱蛋白的产量和纯度有影响
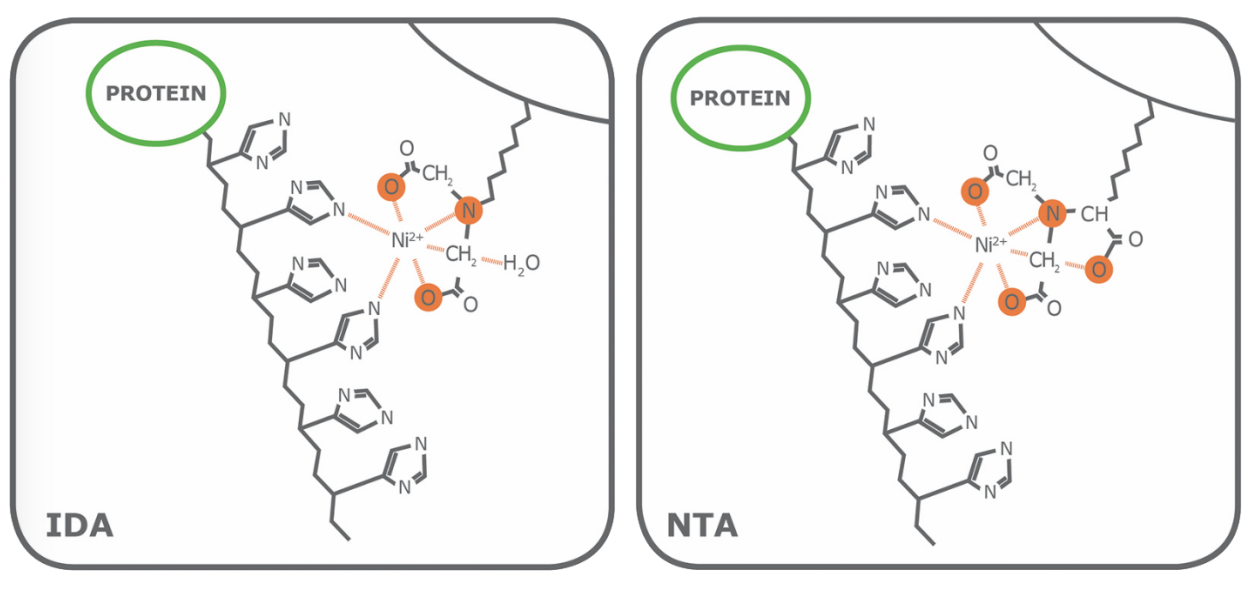
Porath和同事发明了第一个IMAC琼脂糖实物,他们将金属离子通过亚氨基二乙酸(IDA)固定到琼脂糖上。现在商品化IMAC琼脂糖仍广泛使用IDA配体,次氮基三乙酸(NTA)在1987年被Hochuli和同事首次引入商品化IMAC中。在那之后,尽管有其他专用螯合配体(例如 TED, TALON®)陆续问世,但IDA和NTA一直代表最常用的亲和纯化蛋白IMAC琼脂糖。从结构上看,IDA与NTA的区别在于NTA多了一个羧甲基基团。从化学性质上看,额外的功能基团使得NTA与金属离子的配位能力更强,因为NTA拥有四个效价,而IDA只有三个(图1)。
图1:IMAC螯合配体IDA和NTA. IDA和NTA广泛用于将过渡态金属离子结合到基质上,该整体可作为亲和树脂。这两种配体与金属离子结合的价态数目不同(IDA是三价而NTA是四价;价态用橙色标出),这会影响纯化到的蛋白的质量。
当两种配体都有两个价位可以与组氨酸残基的咪唑基相互作用时,配位数对纯化到的蛋白质量有影响。首先,作为一个三价配体(配位数为3),IDA的金属离子漏出率很高,尤其是在平衡和洗脱步骤。尽管NTA琼脂糖的洗脱成分中也含有部分漏出的金属离子,但明显少于IDA树脂。第二,由于目标蛋白性质的变化,用IDA琼脂糖纯化的带组氨酸标签的蛋白通常比用NTA琼脂糖纯化的纯度低。图2显示在大肠杆菌中表达的绿色荧光蛋白,分别用PureCube Ni-IDA和PureCube Ni-NTA纯化后的SDS-PAGE图。IDA琼脂糖纯化的前三个洗脱成分中有清晰的非目的蛋白的裂解产物蛋白条带。
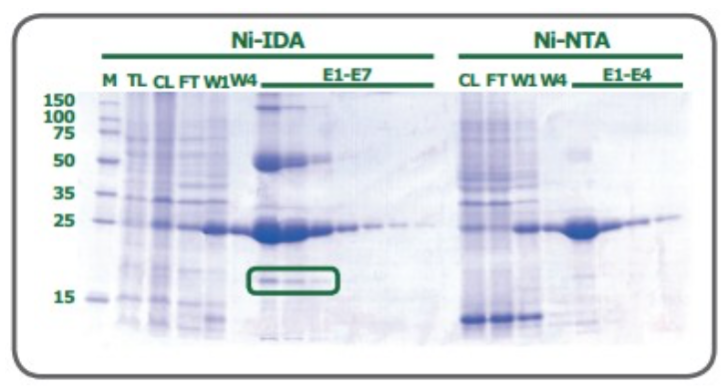
图2:在大肠杆菌中表达的绿色荧光蛋白,分别用PureCube Ni-IDA和PureCube Ni-NTA纯化后的SDS-PAGE图
然而,IDA也有其自身优势,配有IDA配体的琼脂糖通常价格稍低一些。另外,三价配体在洗脱蛋白时需要的咪唑溶液浓度比四价的NTA低。最后,IDA分子更小,可以更高的密度结合到基质上,因此能结合更多的金属离子。通常来说,低装载密度可提高目的蛋白纯化质量降低目的蛋白纯化产量;而高装载密度可提高目的蛋白产量,但会增加非特异性结合。综合考量IDA或NTA的装载密度与不同金属离子的亲和性和特异性(图3),可以提高特定蛋白的纯化产量及质量。
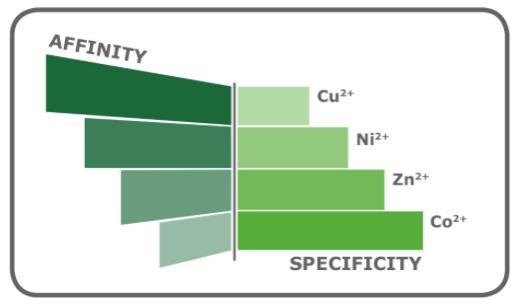
NTA | IDA |
四价,配位数为4 | 三价,配位数为3 |
较高的结合特异性 | 通常有较多的非特异性结合 |
通常较低的产量 | 较低的咪唑洗脱浓度 |
与金属离子较强的配位作用 | 较高的金属离子负载能力 |
较低的金属离子漏出 | 较高的金属离子漏出 |
那么我们应该如何根据不同的蛋白选择适合的配体和金属离子呢,下期我们将详细为您解答,敬请关注!
蛋白决定配体和金属离子
当被问及为何选择某种配体来纯化带组氨酸标签的蛋白而不选择另外一种时,大多数研究者都没有明确的答案。然而,在纯化过程中我们应该尝试使用多种配体,因为IMAC琼脂糖结合蛋白的能力与金属离子的种类和被纯化蛋白的性质密切相关,改变配体-离子组合有可能得到更好的纯化效果。例如,通常IDA的金属离子容量比NTA高(PureCube IDA 琼脂糖Ni2+ 或 Cu2+浓度>25 μmol/mL,而PureCube NTA 琼脂糖Ni2+ 或 Cu2+浓度>15 μmol/mL)。理论上说,IDA有更多的蛋白结合位点,蛋白产量应该更高,正如表1中的JNK1 和GFP,但是不同的蛋白具有不同的结合能力,所以有时产量可能会极低,例如白介素-1β。另外即便是对于同一个带组氨酸标签的蛋白,结合了不同金属离子的琼脂糖对其的亲和性也是不同的。钴的结合特异性高但亲和性低(图3),我们可以看到结合钴的琼脂糖蛋白载量更低(表1)。镍的特异性低而亲和性高,因此蛋白产量明显更高。我们可以通探索不同的金属离子和配体组合来优化带组氨酸标签蛋白的纯化方法。不过需要注意的是,对所有的树脂或所有的蛋白质来说,上述的趋势并不是一成不变的。
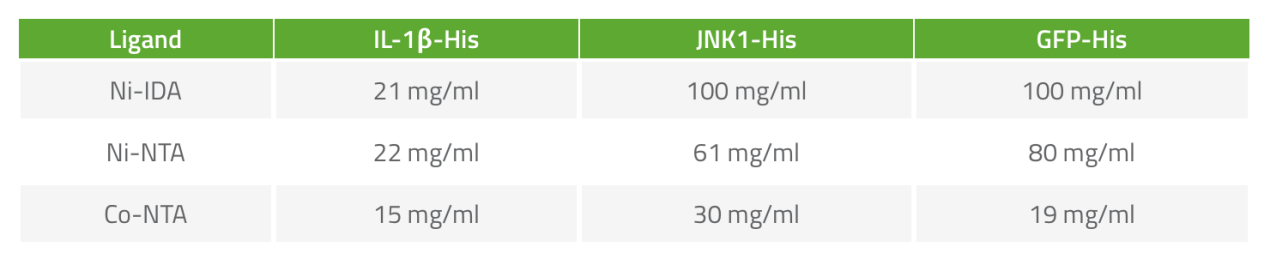
表1:IMAC琼脂糖的结合能力很大程度上取决于金属离子和被纯化蛋白的性质。对不同蛋白进行PureCube组氨酸亲和琼脂糖的标准质量控制测试。某些蛋白如GFP和JNK1产量高,而其他蛋白如白介素1β的产量较低。同时,琼脂糖上装载的金属离子也影响结合能力。首先,钴的蛋白结合特异性比镍高,导致总体上较低的产量。其次,钴与JNK1的相互作用比GFP强,而镍刚好相反。
你的样品中还有什么?
它会影响你选择的标准
被研究样品中的某些化合物的存在会影响IDA-琼脂糖和NTA-琼脂糖的结合能力。DTT(二硫苏糖醇)是一种还原剂,可保护蛋白质的游离巯基不被氧化,破坏SDS-PAGE的样品中的二硫键。DTT可还原IMAC琼脂糖的金属离子,通常会使琼脂糖的颜色变为棕色。通过实验比较发现,PureCube Ni-IDA 琼脂糖和 PureCube Ni-NTA 琼脂糖暴露在不同浓度的DTT溶液中时,两种琼脂糖的结合能力呈非线性比例下降,随DTT浓度的增加,Ni-NTA表现出较慢的下降速率,为8%,而Ni-IDA为11.1%。10 mM DTT下Ni-NTA 和 Ni-IDA的结合能力总体下降为22%和30%。(图4A)
EDTA对于结合能力的影响更为显著。许多缓冲液中有这种六价螯合剂来减少金属离子的干扰。我们的对照实验显示较高浓度EDTA中Ni-NTA比Ni-IDA更有活力。Ni-NTA的结合能力呈非线性降低,EDTA浓度达到1mM时总体下降了46%,之后略微下调。在EDTA浓度达到1mM前, Ni-IDA的结合能力下降幅度与Ni-NTA相似。然后结合能力剧烈下降。(总降低量:65%,图4B)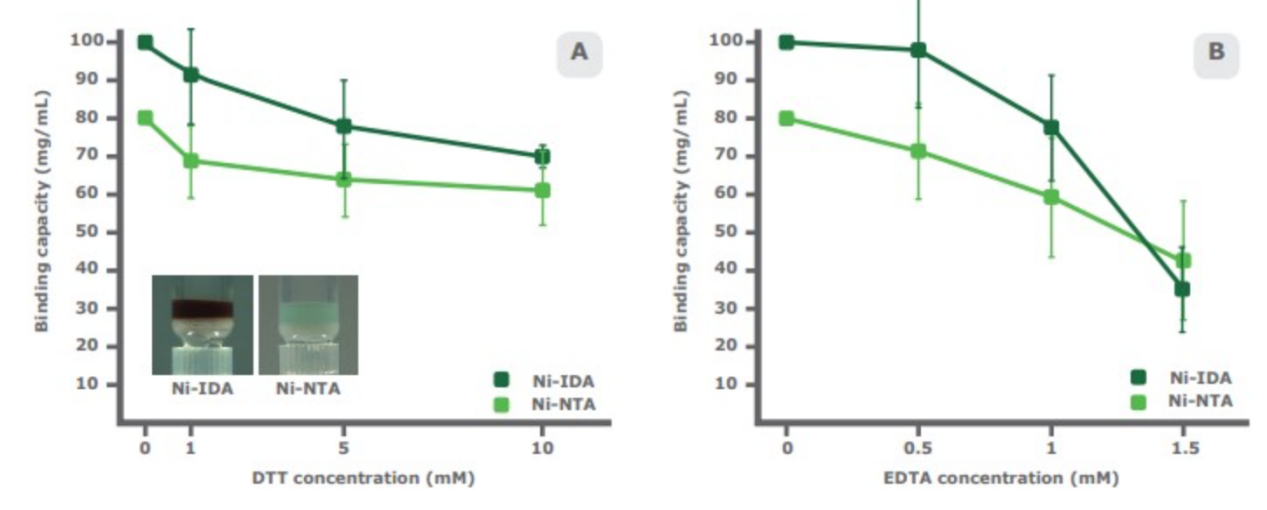
图4: Ni-NTA比Ni-IDA更能耐受还原剂和螯合剂,将PureCube Ni-NTA琼脂糖和PureCube Ni-IDA琼脂糖分别置于三种浓度的DTT(A)和EDTA(B)溶液中处理1h,然后分别用含有上述琼脂糖的重力柱纯化带组氨酸标签的GFP。两种琼脂糖的蛋白结合能力都下降,但Ni-NTA在两种试剂处理后下降更为缓慢,尤其是在高浓度DTT和EDTA处理后。我们也观察到PureCube Ni-NTA琼脂糖在有DTT时没有变成棕色(A的插图)。误差线为初次标准偏差(n=3)
NTA vs. IDA:做出正确的选择
决定用何种IMAC琼脂糖进行蛋白纯化时需考虑以下问题:
*你需要目的蛋白的纯度是多高?
*你需要目的蛋白的产量是多少?
*你的样品中是否含有如DTT或EDTA之类的化学试剂?
*你的预算是多少?
*你对蛋白表达量的预期是多少?
如果你追求高产量,而对蛋白纯度的要求并不高,那么可以选用IDA-琼脂糖。它价格较低,性能稳定,易于再生以及再装载金属离子。为减少非特异性结合,可以尝试使用其他金属离子如锌和钴。如果对蛋白纯度要求高的话(例如,为后续结晶做准备),NTA-琼脂糖是很好的选择。通过装载特异性高的金属离子(如钴)可进一步提高琼脂糖的特异性。NTA-琼脂糖的另一个优点是对如DTT和EDTA之类试剂时有较高的耐受性,因此适用于多种样品缓冲液。琼脂糖种类的选择也很重要,基质和纯化流程会影响最终的结果。另外,纯化蛋白时使用过量的琼脂糖会导致纯度降低,因为很多结合位点没有和目的蛋白结合而暴露。
当纯化少量蛋白时,我们推荐您使用磁珠作为基质;磁珠更适合用于纯化稀释样品中的蛋白、低表达量的蛋白及pull-down实验。如果从中等规模培养物中提取蛋白(>50 μg)推荐选用琼脂糖批量纯化或用重力柱纯化,琼脂糖也可放大用于大量的蛋白的纯化。而预装层析柱可用于蛋白的自动纯化,载量为1-100mg。(图5)
总的来说,如果要优化带组氨酸标签蛋白的纯化过程,需要尝试多种亲和琼脂糖,但只要遵循一定的原则,IMAC琼脂糖的考察和选择也是一个系统化的过程。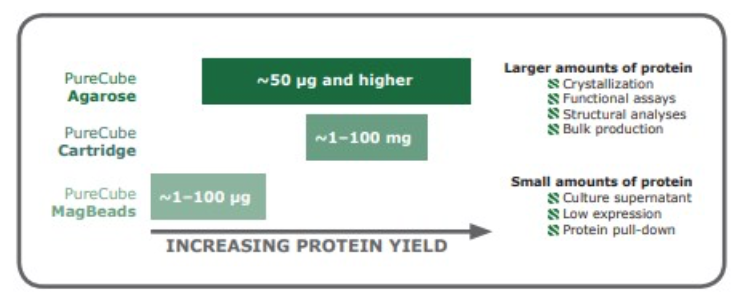
图5:不同形式的IMAC适用于不同的蛋白产量。一般来说,蛋白含量低的样品推荐选用磁珠,大量蛋白的纯化推荐选用琼脂糖。标出的蛋白量仅供参考。
这份说明的总结:
*IDA-琼脂糖价格较低
*NTA-琼脂糖洗脱下来的蛋白通常纯度较高
*NTA-琼脂糖的金属离子漏出率明显较低
*改变金属离子可以改变琼脂糖的结合特异性。Co2+ 离子特异性最强,其次是Ni2+, Zn2+,最后是 Cu2+
*NTA-琼脂糖抵抗还原剂和螯合剂的能力强










 首页
首页 Facebook
Facebook WeChat
WeChat Twiitter
Twiitter
